Глутамин и глутаминолиз
Задачка для раскачки
Дано: средство для роста волос, в составе которого указаны аргинин, аспартат, глицин, аланин, серин, валин, пролин, треонин, изолейцин, гистидин, фенилаланин.
Требуется: определить, какое отношение может иметь каждая из указанных аминокислот к обеспечению жизнедеятельности* волосяного фолликула.
* Подсказка: есть нужды энергетические, а есть всякие другие. Например, мы знаем, что тирозин, без которого невозможно образование меланина, получается из фенилаланина. Таким образом, фенилаланин вряд ли будет "питать" фолликул с точки зрения получения энергии, но, скорее всего, посодействует пигментации - если, конечно, нужные для этого ферменты будут обладать нужной активностью.
Пока же мы разбираем в основном именно энергетический метаболизм, а он в клетках волосяного фолликула реализуется преимущественно аэробным гликолизом и глутаминолизом (R. Williams, M. P. Philpott, T. Kealey, 1993). И если приблизительно понятно, что происходит при этом с глюкозой (10 стадий гликолиза от глюкозы до пирувата и затем большая часть пирувата восстанавливается в лактат), то что при этом происходит с глутамином, мы пока можем только предполагать, опираясь на имеющиеся исследования метаболизма - кто бы мог подумать - различных видов рака. Таких исследований в последнее время по понятным причинам становится все больше и больше. Оказалось, что изучение метаболических ролей глутамина в этом контексте имеет огромное значение, а значит, интересно не только ученым, но и тем, кто дает деньги на исследования, а значит, деньги выдаются, исследования идут.
В PMC имеется множество статей на эту тему, в том числе отличный обзор [1], который положен в основу данной статьи.
Метаболические пути глутамина в быстро делящихся клетках
Соберем и разложим по полочкам следующее: что мы вообще знаем про глутамин? Эта условно-заменимая аминокислота в больших количествах представлена в нашем организме. Благодаря своей структуре глутамин способен выполнять различные функции, что подтверждается следующими физиологическими фактами:
- доля глутамина составляет 20%, то есть одну пятую часть от всех свободных аминокислот в крови;
- глутамину принадлежит доля в 40%, то есть две пятых, всего аминокислотного состава мышц;
- в почках глутамин способствует поддержанию КЩР (кислотно-щелочного равновесия);
- глутамин - главный переносчик аммиака в организме.
Что такого интересного в структуре глутамина? Это аминокислота с двумя аминогруппами (точнее, одна амидо- и одна аминогруппа). Если с глутамина снять амидогруппу, то получится глутамат, а если снять обе группы, то получится альфа-кетокислота альфа-кетоглутарат. И глутамат, и альфа-кетоглутарат выполняют в клетках крайне важные функции, включая энергетические, биосинтетические и регуляторные. А как они это делают, сейчас и будем изучать с чувством, с толком, с расстановкой, занудно и подробно.
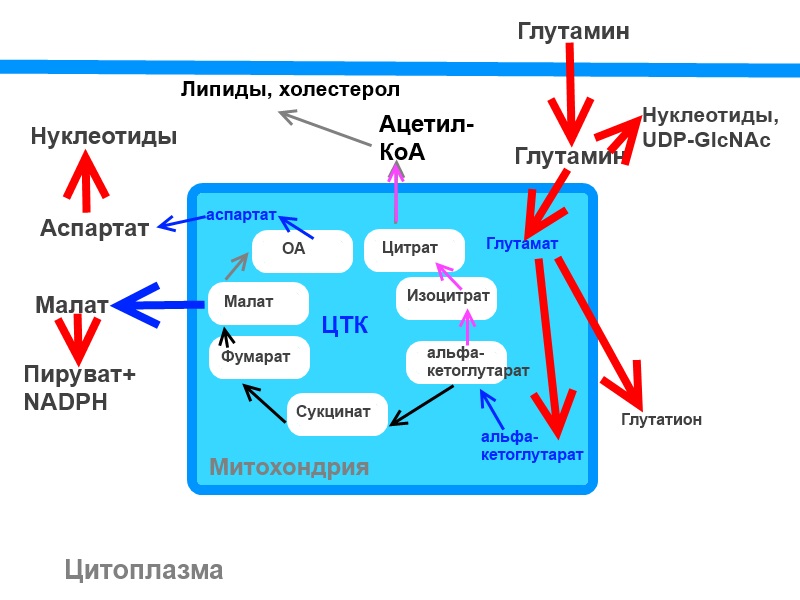
А в митохондриях глутамин дезаминируется и превращается в глутамат**.
** с образованием иона аммония. Вообще-то аммоний, который образуется при дезаминировании аминокислот, у млекопитающих выводится из клеток как раз таки глутамином и отправляется в печень, где при дезаминировании глутамата этот самый ион тут же соединяется с бикарбонатом и быстренько утилизируется в цикле мочевины. Но если мы рассматриваем глутаминолиз в, например, раковых клетках, то там иногда наблюдается феномен, когда эти клетки выделяют аммиак. Этот аммиак может индуцировать аутофагию (понимаемую как "разбор" некоторых собственных органелл на нутриенты) в самой клетке, а может уходить в другие клетки. Как эти клетки обезвреживают аммиак - не очень-то понятно, мы все же не рыбы, которые просто выделяют аммиак в окружающую среду. Есть данные, что в раковых клетках аммиак может использоваться для нейтрализации внутриклеточного pH, но это не точно.
У глутамата, в принципе, есть два основных пути: он может быть вынесен из митохондрии или остаться там. В цитоплазме глутамат может использоваться по "бартеру" (быть обмененным на цистин, то есть окисленную форму цистеина). А может принять участие в синтезе глутатиона, что сильно способствует борьбе клетки со свободными флибустьерами радикалами***.
*** Глутатион – это трипептид, состоящий из глутамата, цистеина и глицина (и мы тут же вспомним, что в составе кератинов волосяного стержня цистеин и глицин представлены в солидных количествах). Основная задача глутатиона - нейтрализация пероксида водорода (и мы тут же вспомним, что пероксид образуется, например, при утечке электронов с дыхательной цепи). Наличие и доступность глутамина является «бутылочным горлышком» для синтеза глутатиона. Кроме того, глутамин прямо и косвенно поставляет 2 компонента для синтеза (глицин может быть синтезирован из глутамина).
В митохондриях из глутамата образуется альфа-кетоглутарат. Это возможно двумя путями: дезаминированием и трансаминированием. Побочным и очень токсичным продуктом дезаминирования является аммоний, а трансаминирование просто переносит аминогруппу на подходящую по нужным параметрам кислоту. И те, и другие реакции обратимы и практически равновесны, но в раковых клетках, как считается, равновесие дезаминирования сдвинуто в сторону отдачи аминогруппы, а не ее принятия. При этом также считается, что в быстроделящихся клетках все-таки преобладают аминотрансферазы (такие, как АсАТ и АлАТ), так как теоретически все продукты такой реакции могут участвовать в биосинтезе. Однако это не догма, и практика показывает, что метаболический профиль подобных клеток может быть разным, и зависит это от разных факторов. Более того, in vitro и in vivo может быть по-разному.
Альфа-кетоглутарат и ЦТК
Наконец, мы приходим к сакраментальному вопросу: какова дальнейшая судьба альфа-кетоглутарата, полученного из глутамина? Мы знаем, что альфа-кетоглутарат является кофактором в реакциях деметилирования гистонов, например, а таже гидроксилирования HIF-1-альфа, и здесь я напомню о новейших исследованиях, которые утверждают важность стабилизации фактора гипоксии для нормального функционирования волосяного фолликула (K.F. Shah, M. Davis, A.Peplow, Y. DeAngelis, B. Farjo, N. Farjo, G. Williams, and M. Philpott, и здесь ); гидроксилирование HIF-1-альфа, как мы знаем, способствует деградации HIF [5, 6]. Поэтому теоретически нам не надо бы альфа-кетоглутарат отдавать пролил-гидроксилазам; тогда, значит, остается ЦТК.
С ЦТК, однако, не все так однозначно, как говорила небезызвестная крымчанка-дочь-офицера(Tm). В аэробных условиях пируват, полученный из глюкозы, окисляется в ЦТК, попадая туда через ПДГк (пируват-дегидрогеназный комплекс). Назовем это каноническим путем. При гипоксии вход пирувата в ЦТК каноническим путем затрудняется, так как HIF ингибирует ПДГк [4] и активизирует превращение пирувата в лактат (что мы, собственно, имеем и в нормально функционирующем волосяном фолликуле). При этом ветка ЦТК от пирувата до альфа-кетоглутарата (почти) не действует. Цитрат, который необходим для синтеза жирных кислот и холестерина, получается восстановительным карбоксилированием из аКГ (на схеме розовые стрелки). Но это еще не все, часть пирувата все же попадает в митохондрии и там трансаминируется до аланина либо пируваткарбоксилазой превращается в оксалоацетат. Оксалоацетат восстанавливается до малата, а малат выводится из митохондрий в цитозоль. Малат из пируватного ОА и малат из глутаминового аКГ дают пируват, который идет, например, на глюконеогенез****. Вот так, например, может функционировать глюкозо-независимый ЦТК [2].
**** так как глюконеогенез не может происходить одновременно с гликолизом в одном и том же месте, то этот пируват, возможно, уходит куда-то в другое место... или превращается в лактат - см. ниже
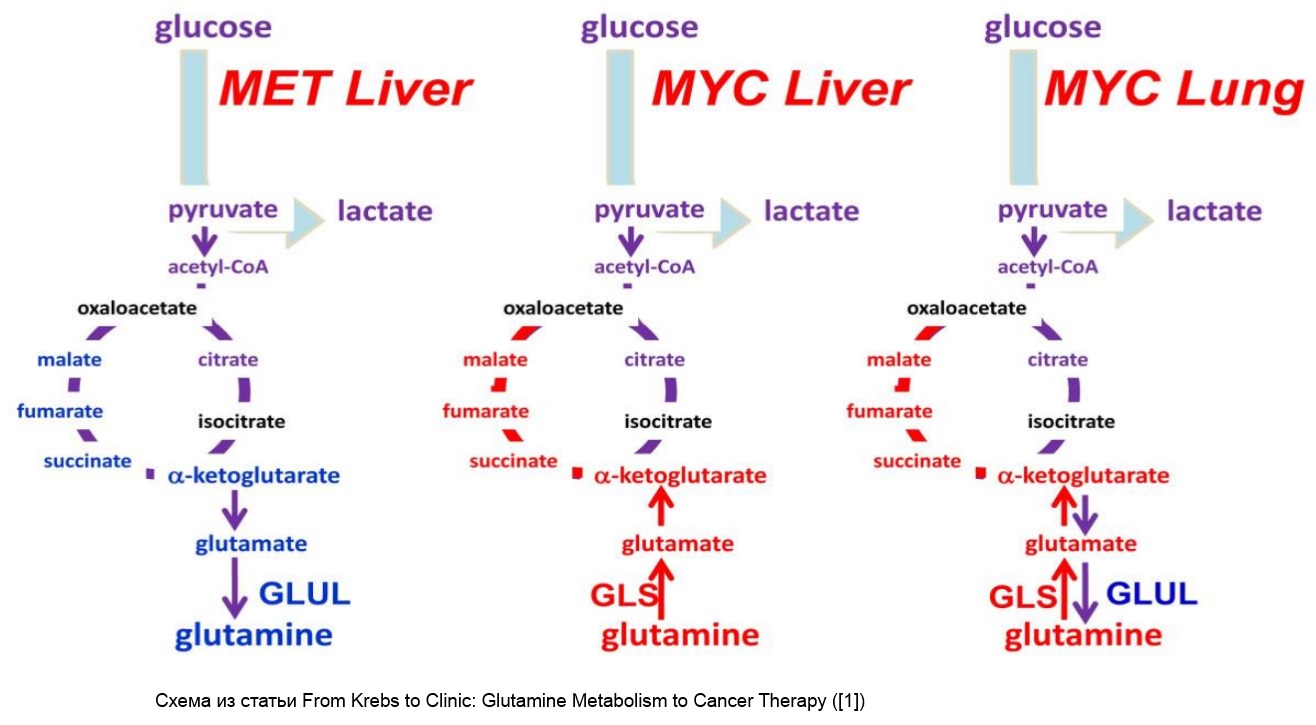
Либо может быть еще вот так. При наличии выраженного эффекта Варбурга пируват тем не менее попадает в митохондрии и далее в ЦТК путем ПДГ комплекса (через образование ацетилКоА), а не через пируваткарбоксилазу (образование оксалоацетата), то есть вполне каноническим путем (и это означает, что HIF-1 не стабилизирован, так как иначе ПДГк не был бы активен; ПК при этом ингибирована, так как ее аллостерически регулирует ацетил-КоА - см. "Основы биохимии Ленинджера", т.2). Вполне канонически образованный цитрат выходит в цитоплазму для синтеза липидов (в которых примерно 60% углерода оказывается "глюкозного" происхождения, и это показано экспериментами с меченой глюкозой). Глутамин же при этом служит для поддержания аминокислотного пула. Также глутамин поставляет интермедиаты для ЦТК (альфа-кетоглутарат), которые на стадии образования малата (или около того) выносятся из митохондрий в цитоплазму. Там образованный малат превращается в пируват, а пируват – в лактат. Таким образом несмотря на аэробное окисление глюкозы в клетке все равно образуется большое количество лактата, однако его источником является не глюкоза, а глутамин (поскольку именно его меченый углерод в большинстве оказался в лактате).
Для чего такие сложности? При задействовании подобных преобразований глутамин оказывается мощным источником NADPH, а NADPH необходим для синтеза нуклеотидов (см. "Основы биохимии Ленинджера", т.2). Нужно также отметить, что в этом случае преобразование глутамина в лактат сопровождается выделением аммония (дезаминирование) и аланина (трансаминирование). Так проходит Аэробный гликолиз в клетках глиобластомы [3].
То есть что мы в итоге видим? Если считать клетку неким "черным ящиком", про который мы ничего не знаем, что происходит у него внутри, а видим только то, что есть на входе (потребление глюкозы и глутамина) и на выходе (лактат), то мы не можем с точностью сказать, какого именно происхождения этот лактат: глюкозного или глутаминового? Канонический или неканонический цикл Кребса идет в этой клетке? Как будут сочетаться между собой роли глюкозы и глутамина в энергетике клетки?
Таким вот черным ящиком для нас сейчас являются клетки волосяного фолликула. Мы можем предполагать, однако, что в нормально функционирующем фолликуле имеет место некоторая вариация неканонического ЦТК, а переход ЦТК на канонические "рельсы" это функционирование, наоборот, затрудняет (что мы видим в исследованиях по поводу HIF-1). Из опытов М. Филпотта, Р. Уильямс и Т. Кили мы знаем, что на одной только глюкозе волос тоже растет, но не так хорошо и быстро, как на смеси с глутамином. Было бы крайне интересно провести опыты с мечеными глюкозой и глутамином и посмотреть, в какие именно интермедиаты эти меченые атомы уходят. Может, такие опыты уже были, а может, еще будут.
Post Scriptum
Что же по поводу приведенной в начале статьи задачки? Если считать, что в состав включены незаменимые аминокислоты, которые в любом случае должны поступать извне, то такой посыл будет логичным, нелогичным будет лишь выбор именно этих аминокислот и невыбор других. Где в списке лейцин, лизин, метионин и триптофан? Метионин необходим для метилирования гистонов, почему его проигнорировали*****? Зато включили аспартат, глицин, аланин и серин, но забыли про цистеин и тирозин, не говоря уже о глутамине... Нет, непонятно.
***** игнор метионина, а также цистеина в коммерческом продукте можно объяснить тем, что эти две аминокислоты содержат серу, а значит, пахнут отнюдь не розами, а производитель указанного продукта в описании его достоинств указывает на приятный аромат оного как на неоспоримое преимущество. Вспомним также пилюли Анакапс, которые раньше пахли тухлыми яйцами серой, а потом перестали, когда в составе перестал быть метионин... или цистеин? Уже не помню, надо уточнить. Эх, дисульфидные мостики, откуда ж вам взяться-то?
Распишем теперь заданные в условии аминокислоты в табличку по принципу конечного продукта, получаемого из каждой аминокислоты (то есть их катаболизма):
| Глюкогенные аминокислоты | Кетогенные аминокислоты | |||||
|---|---|---|---|---|---|---|
| Пируват | Оксалоацетат | Фумарат | Сукцинил-КоА | Альфа-кетоглутарат | Ацетил-КоА | Ацетоацетил-КоА |
| Аланин | Фенилаланин | Аргинин (через глутамат) | ||||
| Глицин | Аспартат | Изолейцин | Изолейцин | |||
| Треонин | Треонин | Гистидин (через глутамат) | Треонин | Фенилаланин | ||
| Валин | Пролин (через глутамат) | |||||
| Серин | ||||||
Теоретически большинство из приведенных аминокислот "сводится" или к пирувату, или к альфа-кетоглутарату, хотя мы уже понимаем, что глутамин тут справился бы лучше. Фумарат, получаемый из фенилаланина, это по сути тот же малат (то есть как бы снова пируват). С сукцинил-КоА, получаемым из изолейцина, валина и треонина, будет поинтереснее, так как получаемый из него в ЦТК сукцинат еще и "питает" дыхательную цепь, после чего сводится к малату, а задачка сводится к предыдущей. Изолейцин и треонин, да и тот же фенилаланин, являются кетогенными аминокислотами (однако мы знаем, что основой для синтеза жирных кислот и холестерина прекрасно служит цитрат из ЦТК).
Конечно, нельзя утверждать, что эти аминокислоты будут совершенно бесполезны для активации роста волос, это скорее всего не так или не вполне так (см., например, [7]). Однако наша задача - объяснять все как максимум с научных и как минимум с рациональных позиций, ну или по крайней мере попытаться объяснить.
И таким образом пока мы точно не знаем, какую роль в жизнедеятельности волосяного фолликула играет та или иная аминокислота из перечисленных в условии задачки (кроме, пожалуй, глицина и, возможно, аланина с аспартатом и в некоторой степени фенилаланина), мы можем считать подобный набор аминокислот во многом спекулятивным. Помогает ли именно этот набор росту волос? Может, помогает, может, не помогает, это как динозавра встретить на улице: 50/50.
Post Post Scriptum
На этом пока завершим с глутамином и ЦТК и, скорее всего, перейдем к очень важной теме синтеза меланинов в волосяном фолликуле - теме, исследованием которой вплотную занимаются такие замечательные люди, как Анджей Сломински и Десмонд Тобин (и, конечно, Ральф Паус, который исследует ВСЕ про волосяной фолликул!).
Мы будем рассматривать образование пигментов в волосяном фолликуле с точки зрения биохимии процесса и снова столкнемся с метаболизмом аминокислот (а куда без этого?)
Продолжение следует.
Литература:
-
Brian J. Altman, Zachary E. Stine, and Chi V. Dang
From Krebs to Clinic: Glutamine Metabolism to Cancer Therapy -
Anne Le, Andrew N. Lane, Max Hamaker, Sminu Bose, Arvin Gouw, Joseph Barbi, Takashi Tsukamoto, Camilio J. Rojas, Barbara S. Slusher, Haixia Zhang, Lisa J. Zimmerman, Daniel C. Liebler, Robbert J.C. Slebos, Pawel K. Lorkiewicz, Richard M. Higashi, Teresa W. M. Fan, and Chi V. Dang
Glucose-independent glutamine metabolism via TCA cycling for proliferation and survival in B-cells -
Ralph J. DeBerardinis, Anthony Mancuso, Evgueni Daikhin, Ilana Nissim, Marc Yudkoff, Suzanne Wehrli, and Craig B. Thompson
Beyond aerobic glycolysis: Transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis -
Подробно о том, как именно взаимодействуют HIF-1 и PDH, см. здесь:
Jung-whan Kim, Irina Tchernyshyov, Gregg L. Semenza, Chi V. Dang
HIF-1-mediated expression of pyruvate dehydrogenase kinase: A metabolic switch required for cellular adaptation to hypoxia -
Подробно о стабилизации HIF-1-альфа:
Lee JW, Bae SH, Jeong JW, Kim SH, Kim KW.
Hypoxia-inducible factor (HIF-1)alpha: its protein stability and biological functions. -
Подробно о регуляции HIF-1-альфа белком фон Гиппель-Линдау:
Keiji Tanimoto, Yuichi Makino, Teresa Pereira, and Lorenz Poellinger
Mechanism of regulation of the hypoxia-inducible factor-1α by the von Hippel-Lindau tumor suppressor protein -
А вот здесь в целом о роли гликолиза и глутаминолиза по сравнению с тем, какую роль играют другие аминокислоты в быстро делящихся клетках:
Aaron M. Hosios, Vivian C. Hecht, Laura V. Danai, Marc O. Johnson, Jeffrey C. Rathmell, Matthew L. Steinhauser, Scott R. Manalis, and Matthew G. Vander Heiden
Amino acids rather than glucose account for the majority of cell mass in proliferating mammalian cells
Дополнительная литература, которую интересно почитать:
-
Jing Ge, Huachun Cui, Na Xie, Sami Banerjee, Sijia Guo, Shubham Dubey, Stephen Barnes, and Gang Liu
Glutaminolysis Promotes Collagen Translation and Stability via α-Ketoglutarate–mediated mTOR Activation and Proline Hydroxylation -
Ralph J. DeBerardinis, M.D., Ph.D. and Tzuling Cheng, Ph. D.
Q's next: The diverse functions of glutamine in metabolism, cell biology and cancer -
Su Yeon Lee, Hyun Min Jeon, Min Kyung Ju, Eui Kyong Jeong, Cho Hee Kim, Hye Gyeong Park, Song Iy Han, and Ho Sung Kang
Dlx-2 and glutaminase upregulate epithelial-mesenchymal transition and glycolytic switch -
Christian M. Metallo, Paulo A. Gameiro, Eric L. Bell, Katherine R. Mattaini, Juanjuan Yang, Karsten Hiller, Christopher M. Jewell, Zachary R. Johnson, Darrell J. Irvine, Leonard Guarente, Joanne K. Kelleher, Matthew G. Vander Heiden, Othon Iliopoulos, and Gregory Stephanopoulos
Reductive glutamine metabolism by IDH1 mediates lipogenesis under hypoxia
